Exercice : Condensateur plan en régime sinusoïdal rapidement variable
Un condensateur
plan est constitué par deux disques métalliques de rayon R et de même axe ∆ dans le vide. On applique au condensateur
suivant la direction ∆ prise
comme axe Oz, un champ électrique uniforme et sinusoïdal $\overrightarrow{E1}=\overrightarrow{E0}{{e}^{i\omega
t}}$ . On néglige les effets de bord.
1- Montrer
que $\overrightarrow{E1}$ crée un champ
magnétique $\overrightarrow{B2}$ . A
partir des lignes de champ de $\overrightarrow{E1}$ , quelles sont les
lignes de champ de $\overrightarrow{B2}$ ? Exprimer $\overrightarrow{B2}$
en un point disant de ρ de
l’axe ∆ en
fonction de ρ, t,ω, $\overrightarrow{E1}$ et c avec $\varepsilon
0\mu 0c{}^\text{2}=1$ .
2- Monter
qu’à son tour $\overrightarrow{B2}$ crée un champ électrique $\overrightarrow{E3}(\rho
)$ . Quelle est la direction des lignes de champ de $\overrightarrow{E3}$ ?
Sachant que $\overrightarrow{E3}$ est nul sur l’axe ∆, Exprimer le champ $\overrightarrow{E3}$
en un point distant de ρ de l’axe
∆ en fonction de $\overrightarrow{E1}$, ρ, ω et c
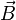 (M) =
(M) = 




